Hidrogênio
O hidrogênio é o elemento químico mais leve e o mais abundante entre todos os elementos já registrados.
No ambiente natural da Terra, o hidrogênio livre (não combinado) é relativamente raro. Em temperatura e pressão padrão, ele toma a forma de um líquido incolor, inodoro, insípido e altamente inflamável feito de moléculas diatômicas.
Por outro lado, o elemento é amplamente distribuído em combinação com outros elementos, e muitos de seus compostos são vitais para sistemas vivos. Seu composto mais familiar é a água (H2O).
O termo hidrogênio pode ser atribuído a uma combinação das antigas palavras gregas hydor, que significa “água”, e genes, que significa “formação”. Isso se refere à observação de que, quando o hidrogênio queima, produz água.
História
O gás hidrogênio, H2, foi produzido artificialmente pela primeira vez e formalmente descrito por T. Von Hohenheim através da mistura de metais com ácidos fortes. Ele não sabia que o gás inflamável produzido por essa reação química era um novo elemento químico. Em 1671, Robert Boyle descobriu e descreveu a reação entre depósitos de ferro e ácidos diluídos, o que resulta na produção de gás hidrogênio.
Em 1766, Henry Cavendish foi o primeiro a reconhecer o gás hidrogênio como uma substância, identificando o gás de uma reação ácido-metal como “ar inflamável” e descobrindo que o gás produz água quando queimado. Cavendish havia chegado a essas conclusões quando fazia experimentos com ácidos e mercúrio.
Embora ele erroneamente assumisse que o hidrogênio era um componente liberado do mercúrio em vez do ácido, ele ainda era capaz de descrever com precisão várias propriedades-chave do hidrogênio. Ele geralmente recebe crédito pela descoberta do elemento. Em 1783, Antoine Lavoisier deu ao elemento o nome “hidrogênio” quando ele (com Pierre-Simon Laplace) reproduziu a descoberta de Cavendish de que a água é produzida quando o hidrogênio é queimado.
Um dos primeiros usos de hidrogênio foi para balões e dirigíveis. O hidrogênio era obtido por uma reação de ácido sulfúrico e metal de ferro. O gás foi usado no dirigível de Hindenburg, que foi destruído em chamas enquanto voava. O hidrogênio altamente inflamável foi posteriormente substituído pelo hélio não reativo.
Isótopos
O hidrogênio tem três isótopos de ocorrência natural, denominados 1H(Protium), 2H(Deutério) e 3H(Tritium). Outros núcleos altamente instáveis (4H a 7H) foram sintetizados em laboratório, mas não foram observados na natureza.
Propriedades
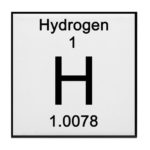
O hidrogênio é o elemento mais leve da tabela periódica, com uma massa atômica de 1,00794 g/mol. Por falta de um lugar melhor, geralmente é mostrado no topo do grupo 1 (antigo grupo 1A). É, no entanto, um não-metal, enquanto os outros membros do grupo 1 são metais alcalinos.
Para que serve?
É utilizada uma quantidade elevada de H2 em indústrias de petróleo e química. A maior aplicação de H2 é para o processamento de combustíveis fósseis e na produção de amônia.
H2 tem várias outras funções notáveis, sendo usado também como agente hidrogenante, em especifico no aumento do nível de saturação de gorduras e óleos insaturados (você encontra em elementos como a margarina) e na produção de metanol.
Além das utilizações citadas anteriormente, é relevante informar que o H2 tem larga aplicação também na física e engenharia. É usado como gás de proteção em métodos de soldagem, como a soldagem atômica de hidrogênio. H2 também é usado como o refrigerante do rotor em geradores elétricos em usinas, porque tem a mais alta condutividade térmica de qualquer gás.
Dados
Massa atômica – 1,00794(7) u
Configuração eletrônica – 1s¹
Elétrons – 1
Estado da matéria – Gasoso
Ponto de fusão – 14,025 K
Ponto de ebulição – 20,268 K
Entalpia de fusão – 0,05868 kJ/mol
Entalpia de vaporização – 0,44936 kJ/mol
Volume molar – 1,14×10–⁵ m³/mol

Os comentários estão fechados, mas trackbacks E pingbacks estão abertos.