Escala de pH
Os valores da escala de pH foram definidos de acordo com a ionização da água. Confira!
O pH representa o potencial de hidrogênio e serve para medir a acidez, neutralidade ou alcalinidade de uma solução.
Valores de referência para pH
Os valores são estabelecidos para o pH com base na constante de ionização (Kw) da água que é 10-14 a temperatura constante de 25 °C.
A água a 25 °C, a concentração de íons H+ e OH– são as mesmas, sendo 10-7 mol/L para cada, ou seja, a água pura a 25 °C é neutra.
Escala de pH
De acordo com a constante de ionização da água, os valores da escala de pH foram definidos entre 0 e 14, sendo pH 7 o meio da escala, ou seja, uma solução neutra.
- Soluções ácidas: pH menor que 7;
- Soluções neutras: ph 7;
- Soluções básicas ou alcalinas: pH com valor maior que 7.
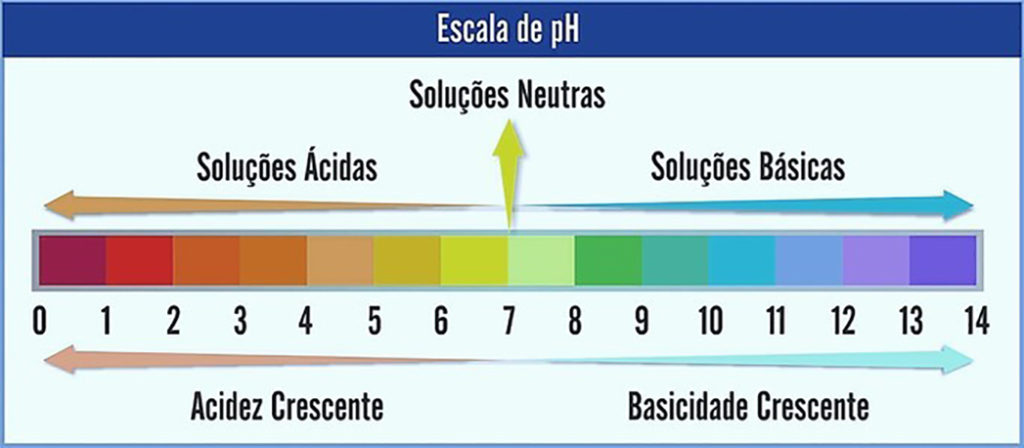
Podemos observar que o caráter ácido é determinado da direita para a esquerda na escala, em números crescentes, ou seja, quanto menor o valor de pH, mais ácida a solução se torna.
O caráter básico é determinado na escala da esquerda para a direta, em ordem decrescente, isso quer dizer que quanto maior for o valor de pH, mais alcalina a solução se tornará.
O pH pode ser medido através de indicadores ácido-base que muda de cor ou do peagâmetro que mede a quantidade de íons H+ disponíveis no solvente.


Exemplos de soluções ácidas
- Café: pH 5,0
- Suco gástrico: pH 2,0
- Vinagre: pH 3,0
- Leite de vaca: pH 6,4
- Suco de limão: pH 2,2
Exemplos de soluções básicas ou alcalinas
- Água do mar: pH 7,4
- Leite de magnésia: pH 10,5
- Sangue humano: pH 7,35
- Alvejante: pH 12,5
- Bicarbonato de sódio: pH 8,4
Veja também:

Os comentários estão fechados, mas trackbacks E pingbacks estão abertos.