O que é pH?
O pH é uma sigla utilizada classificar uma solução através da concentração de hidrônios ou hidroxilas, podendo ser ácida, neutra ou básica.
O pH representa o potencial hidrogeniônico que uma solução possui, ou seja, a quantidade de cátions hidrônio (H+ ou H3O+) que ela tem disperso no solvente.
A quantidade de íons de hidrogênio serve para medir a acidez, neutralidade ou alcalinidade de uma solução.
A determinação desses índices só se tornou possível quando cientistas químicos perceberam que a água era uma solução autoionizável, ou seja, capaz de produzir hidrônios (H+) e hidróxidos (OH–). Por isso, uma solução aquosa sempre apresentará os dois tipos de íons.
Valores de referência para pH
Os valores de pH são baseados na constante de ionização (Kw) da água que é 10-14 a uma temperatura de 25°C.
A essa temperatura, a concentração de íons hidrônio e hidróxido são iguais, sendo 10-7 mol/L para cada um.
A partir disso, os valores para pH foram definidos parar variar entre 0 e 14, sendo pH 7 uma solução neutra, como é o caso da água pura.
As soluções com valores de pH menores que 7 são consideradas ácidas e as que possuem pH com valor maior que 7 são consideradas soluções básicas ou alcalinas.
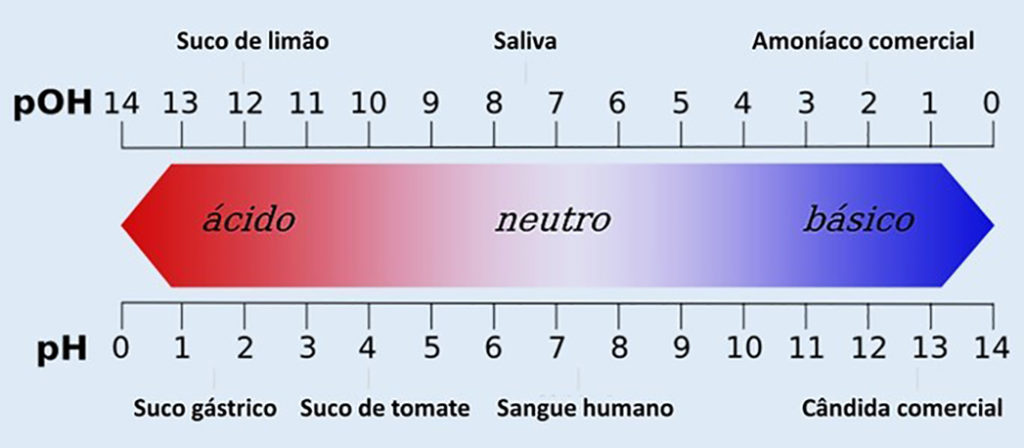
Sendo assim, o caráter ácido é determinado da direita para a esquerda, de forma crescente, ou seja, quanto menor o valor de pH, mais ácida será a solução.
Já o caráter básico é determinado da esquerda para a direta, em ordem decrescente, ou seja, quanto maior o valor de pH for, mais alcalina será a solução.
Como calcular o pH?
O cálculo do pH foi proposto pelo dinamarquês Soren Sörensen (1868–1939) que transformou os valores de concentração em íons para logaritmos.
Vamos usar a água como exemplo:
A água possui um produto iônico 10–14 mol2/L2, se aplicarmos o logaritmo da expressão dela temos:
Sendo assim:
pH = 14 – pOH
pOH = 14 – pH
Como medir o pH?
Conhecer o pH de uma solução é importante tanto para uso científico quanto para usos do cotidiano, como a manutenção da qualidade da água de piscinas e aquários.
O pH de uma solução pode ser medido através de teste indicador ácido-base ou utilizando um peagâmetro.
- Indicador ácido-base: são fitas coloridas que mudam de cor indicando o caráter da solução através de uma escala previamente definida pelo fabricante. Os mais utilizados são o tornassol e a fenolftaleína.

- Peagâmetro: é um instrumento eletrônico que mede a condutividade elétrica da solução e converte para a escala de pH.

Exemplos de soluções
Soluções ácidas
- Suco gástrico: pH 2,0
- Suco de limão: pH 2,2
- Vinagre: pH 3,0
- Café: pH 5,0
- Leite de vaca: pH 6,4
Soluções básicas ou alcalinas
- Sangue humano: pH 7,35
- Água do mar: pH 7,4
- Bicarbonato de sódio: pH 8,4
- Leite de magnésia: pH 10,5
- Alvejante: pH 12,5
Veja também:

Os comentários estão fechados, mas trackbacks E pingbacks estão abertos.