Estados Físicos da matéria
Os diferentes estados físicos e suas transformações nos ajudam a compreender e visualizar as partículas que compõem a matéria.
A matéria com que interagimos é formada por átomos, pequenas partículas que podem se organizar de diferentes formas, dependendo da temperatura e pressão do meio. A água (H₂O) é o exemplo clássico para explicar as transformações físicas da matéria pois suas moléculas se agrupam de diferentes formas. Todos usamos em nosso cotidiano moléculas de água em estado de gelo, de água líquida e de vapor.
Os estados da água são tão importantes que deram origem à escala de temperatura mais usada no ocidente, a escala célsius, onde, no nível do mar, o zero é o ponto de fusão e cem o ponto de ebulição. Para visualizar como esse fenômeno funciona, imagine as moléculas de água em temperatura ambiente. Elas formam um líquido onde fluem desordenadamente, mas em volume constante.
Se diminuirmos a temperatura, ou aumentarmos a pressão, as moléculas de água ficam mais unidas, formando cristais que, diferente do líquido, têm forma fixa. A força que une esses cristais fazem com que seu volume e a configuração não se altere.
No caminho oposto, se aumentarmos a temperatura, ou diminuirmos a pressão, a água líquida passa para o estado gasoso. Em vapor, as moléculas se movimentam livremente umas das outras, com volume e forma variável. São comprimíveis e expansíveis, se misturando facilmente ao ar atmosférico (umidade relativa do ar).
A temperatura nada mais é do que o grau de agitação das moléculas. A pressão é a força exercida sobre elas. Compreender esses conceitos ajuda a visualizar como a alta agitação das moléculas faz com que se choquem com maior frequência e se desagreguem, e a baixa agitação faz com que seja mais fácil com que se liguem de forma estável. Semelhantemente, uma alta pressão sobre as moléculas as força a se unirem e a baixa pressão faz com que seja mais fácil que se separem.
Entretanto, talvez a água não seja o melhor exemplo para estudarmos os estados da matéria, pois ela é uma exceção no sentido de que suas moléculas em estado sólido não são mais densas do que no estado líquido. Enquanto muitos materiais (como os metais) se contraem, a água na verdade se expande. Você já pode ter notado como garrafas cheias de água quebram no congelador.
Isso acontece porque a geometria molecular da água favorece a formação de cristais que ocupam mais espaço do que ocupariam as mesmas moléculas se estivessem livres. Isto é, o ângulo de 104,5º entre um átomo de hidrogênio e outro faz com que as pontes de hidrogênio que unem as moléculas de água formem grandes cristais.
Essa peculiaridade permite a vida na Terra, pois faz com que o gelo, menos denso, flutue sobre a água. Isso permite que água seja conservada líquida sob camadas de gelo em oceanos e lagos.
Transformações de estado
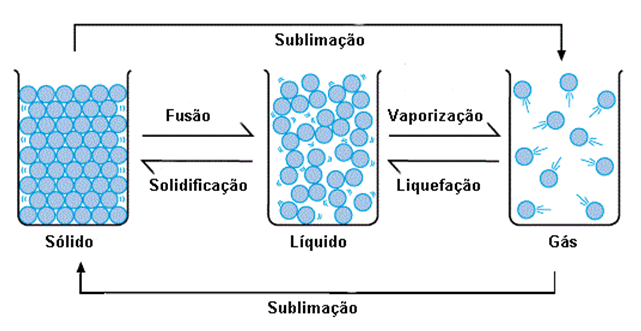
As mudanças de estado físico dizem respeito a conformidade que partículas assumem em conjunto. A principal característica dessas transformações é que elas podem ser revertidas. Cada mudança tem um nome:
- Sólido para líquido: fusão
- Sólido para gasoso: sublimação
- Líquido para sólido: solidificação
- Líquido para gasoso: vaporização (evaporação, se o processo for lento; ebulição, se for rápido)
- Gasoso para sólido: ressublimação
- Gasoso para líquido: condensação ou liquefação
O quarto estado da matéria
Raro na Terra, mas muito comum nas estrelas que compõem grande parte da massa do universo, o plasma se forma quando gases são aquecidos a temperaturas altíssimas. Esse é classificado como um novo estado porque em regiões como o centro do sol, onde as temperaturas podem chegar a 84.000 ºC, o grau de agitação é tamanho que a força que mantém os componentes do átomo unidos é vencida.
A matéria então se comporta de forma diferente. Ela torna-se uma massa disforme, com elétrons sendo arrancados das moléculas e fazendo-as se tornar íons e núcleos dissociados.

Os comentários estão fechados, mas trackbacks E pingbacks estão abertos.