Paládio
O paládio é um membro dos metais de transição e assemelha-se a platina quimicamente.
Para que serve?
O paládio e seus compostos são catalisadores extremamente valiosos para várias reações químicas, e pode ser encontrado em conversores catalíticos automotivos. Ligas de paládio são usadas em joias. Além disso, este elemento é útil em várias outras aplicações, incluindo odontologia, relojoaria, velas de ignição de aeronaves, instrumentos cirúrgicos e contatos elétricos.
O hidrogênio absorvido no paládio é altamente reativo e é usado em reações de redução. O dicloreto de paládio pode ser usado em detectores de monóxido de carbono e testes para a resistência à corrosão do aço inoxidável.
História
O paládio foi descoberto por William Hyde Wollaston em 1803 na Inglaterra. Usando um minério de platina que presumivelmente veio da América do Sul, ele realizou uma série de reações químicas e obteve o composto cianeto de paládio.
Finalmente, aquecendo o cianeto de paládio, ele foi capaz de isolar o metal paládio. Ele nomeou o elemento em 1804, derivando a palavra de Pallas, o nome de um asteróide descoberto dois anos antes.
Características
O paládio é classificado como um metal de transição. Na tabela periódica , situa-se no período cinco entre o ródio e a prata e está intimamente relacionado com os dois últimos elementos. Além disso, está situado no grupo dez (antigo grupo 8B), entre o níquel e a platina.
Este metal branco-prateado não reage com o oxigênio em temperaturas normais e, portanto, não mancha no ar. No entanto, adquire uma mancha clara no ar úmido contendo enxofre.
Este elemento assemelha-se à platina, mas entre os metais do grupo da platina, tem a menor densidade e ponto de fusão. É macio e dúctil quando recozido, mas aumenta muito em força e dureza quando trabalhado a frio. O paládio é quimicamente atacado por ácido sulfúrico, ácido nítrico e ácido clorídrico, no qual se dissolve lentamente. Quando é aquecido a 800 °C, é produzida uma camada de óxido de paládio (II) (PdO).
O paládio tem a incomum capacidade de absorver até 900 vezes seu próprio volume de hidrogênio à temperatura ambiente. Ao absorver hidrogênio, ele se expande visivelmente, como uma esponja que incha ao absorver a água. Ao fazê-lo, pensa-se que forma hidreto de paládio, mas os cientistas não têm certeza se este é um composto químico verdadeiro.
Dados
Massa atômica – 106,42 u
Configuração eletrônica – [Kr] 4d10
Elétrons – 2, 8, 18, 18
Estado da matéria – sólido
Ponto de fusão – 1828,05 K
Ponto de ebulição – 3236 K
Entalpia de fusão – 17,6 kJ/mol
Entalpia de vaporização – 357 kJ/mol

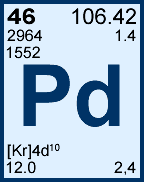
Os comentários estão fechados, mas trackbacks E pingbacks estão abertos.