Protactínio – Elemento Químico Protactínio (Pa)
Apesar de ser supercondutor a temperaturas abaixo de 1,4K, o protactínio não apresenta nenhuma aplicação significativa.
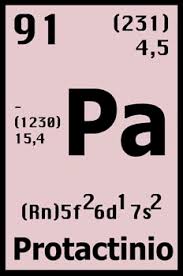
O protactínio (Pa) é um metal de transição interna (fazendo parte da série dos actinídeos). À temperatura ambiente, o elemento encontra-se no estado sólido.
Tem caráter tóxico e altamente radioativo, em função da emissão de partículas alfa. Por isso, requer precauções de manuseio semelhantes àquelas usadas com o plutônio. Assim como qualquer outro radioisótopo, pode causar câncer e mutações no DNA das células.
História
Mendeleev, um químico e físico russo, criador da primeira versão da tabela periódica dos elementos químicos, que comumente previa as propriedades de elementos que ainda não tinham sido descobertos, disse que deveria haver um elemento entre tório e urânio, mas evitou detecção.
No ano de 1913, o primeiro isótopo descoberto foi o 234Pa, um membro da série natural de decaimento do 238U.
Em 1918, Hahn e Meitner descobriram o isótopo de vida mais longa ( 231Pa), e o batizaram de protoactínio. Somente em 1949, o nome foi simplificado para protactínio, como é conhecido atualmente.
Em 1927, Grosse obteve 2 mg de Pa2O5. Em 1934, o elemento foi isolado a partir da conversão do óxido em iodeto e posterior craqueamento por um filamento aquecido sob vácuo (2PaI5®2Pa+5I2).
Propriedades
- Apresenta um brilho metálico, que permanece por algum tempo se exposto ao ar;
- O manuseio é perigoso e requer os proteções semelhantes às usadas para o plutônio;
- Torna-se um supercondutor em temperaturas abaixo de 1,4 K;
- Esse metal está na série de decaimento do urânio e, assim como seu predecessor, é instável;
- Seus estados de oxidação podem variar entre +2 e +5, sendo +4 e +5 os mais comuns;
- Sua eletronegatividade assume valor 1,5 (comum aos metais, mesmo os de transição) na escala Pauling;
- Protactínio forma compostos com os átomos de halogênio (flúor, cloro, bromo, e iodo) e com hidrogênio;
- Possui densidade específica bastante elevada: 15370 Kg/m³, e os valores de ponto de fusão e ebulição giram em torno de 1570°C e 4030°C, respectivamente;
- Sua estrutura cristalina é forte o bastante para mantê-lo em estado de agregação sólido até em condições mais extremas.
Para que serve?
Como o Pa-234 possui pequena meia-vida (menos de 7 horas), o protactínio sob forma natural é muito raro. Por isso, além de sua alta radioatividade e toxicidade, não existe atualmente nenhum uso para o protactínio fora do âmbito da pesquisa científica básica.
Isótopos
| Simb | % Natural | Massa | Meia Vida | Decaimento |
| 228Pa | 0 | 228,0310 | 22 h | CE p/ 228Th a p/ 224Ac |
| 229Pa | 0 | 229,0321 | 1,5 d | CE p/ 229Th a p/ 225Ac |
| 230Pa | 0 | 230,0345 | 17,4 d | CE p/ 230Th a p/ 226Ac b– p/ 230U |
| 231Pa | 100 | 231,0359 | 3,25 104 a | a p/ 226Ac FE |
| 232Pa | 0 | 232,0386 | 1,31 d | CE p/ 232Th b– p/ 232U |
| 233Pa | 0 | 233,0402 | 27 d | b– p/ 233U |
| 234Pa | 0 | 234,0433 | 6,69 h | b– p/ 234U |
Dados
Número atômico: 91
Configuração eletrônica: [Rn] 5f2 6d1 7s2
Massa atômica: 231,036
d = 15,37 g.cm-3 (calculada)
Ponto de fusão: 1600,0 ° C (K 1873,15, 2912,0 ° F)
Ponto de ebulição: Desconhecido
Número de prótons / Elétrons: 91
Número de nêutrons: 140
Densidade @ 293 K: 15,4 g / cm 3
Cor: Desconhecido.
Usos: Não utilizações conhecidas
Obtido a partir de: produtos de fissão do urânio, tório, plutônio.

Os comentários estão fechados, mas trackbacks E pingbacks estão abertos.